近期,四川新生命干细胞科技股份有限公司干细胞研发团队在英国Nature(自然)杂志旗下子刊 Scientific Reports(科学报告)期刊在线发表了一项来源于围产期胎盘组织和脐带组织的间充质干细胞的生物学特性比较研究。

人类胎盘不仅在胎儿发育、营养和免疫耐受方面发挥着基础性作用,同时作为一种间充质干细胞的重要来源,在再生医学方面有巨大的潜力。因此胎盘来源的间充质干细胞获取容易,也没有侵入性过程,对产妇不会造成任何伤害,不存在任何伦理争议,但胎盘组织往往被当作医疗废物扔掉。
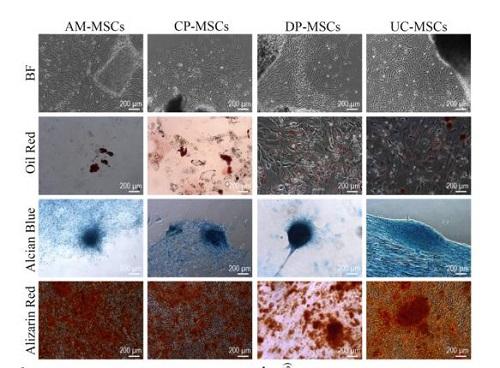
胎盘组织结构可分为羊膜(AM)、绒毛膜(CP)和底蜕膜(DP)三种组织。
本文研究人员对胎盘三种组织来源和脐带(UC)来源间充干细胞进行了比较研究:
HLA分型和染色体核型分析证实,AM、CP和UC来源间充质干细胞来源于胎儿,DP来源间充质干细胞则源于母体。
四种间充质干细胞增殖潜能存在显著差异,增殖率从最快到最慢分别是UC、AM、CP和DP来源间充质干细胞。生长曲线显示,源自胎儿的间充质干细胞增殖能力明显大于母体间充质干细胞的增殖能力。
研究人员还发现,来自不同围产期组织间充质干细胞的生物学特性也不尽相同。虽然不同来源的间充质干细胞均表现出与国际细胞治疗协会(ISCT)定义间充质干细胞最低标准(CD73、90、105阳性,CD14、34、45和HLA-DR阴性)一致的特性,但是,同其他来源的间充质干细胞相比,CP来源间充质干细胞的CD106的表达具有显著差异。CD106,也称为血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM-1),在间充质干细胞发挥免疫调节和促血管新生的功能中起重要作用。在CP来源间充质干细胞中,CD106的表达远高于其他三种组织。
此外,不同组织来源的间充质干细胞(MSCs)分泌的生长因子和细胞因子存在很大的差异。这些因子包括人血管生成素-1(Ang-1),肝细胞生长因子(HGF),胰岛素样生长因子I(IGF-I),前列腺素E2(PGE2),转化生长因子β1(TGF-β1),VCAM-1和血管内皮生长因子(VEGF)。
四种组织中,AM来源间充质干细胞的PGE2和TGF-β1分泌量最高;CP来源间充质干细胞的HGF和VCAM-1分泌量最高;DP来源间充质干细胞的Ang-1和VEGF分泌量最高,TGF-β1的分泌量最低;而UC来源间充质干细胞的IGF-I分泌量最高。

文章第一作者,新生命干细胞公司干细胞与再生医学研究中心高级研究员伍明俊博士表示,脐带与胎盘来源的间充质干细胞由于分泌的细胞因子和生长因子有所不同,此研究有望指导未来不同组织来源间充质干细胞应用于不同的疾病。比如有文献报道AM来源间充质干细胞用于治疗卵巢早衰更优,可能与其分泌高水平的PGE2、TGF-β1有关,还有文献报道CP来源间充质干细胞有更好的潜在的促血管生成作用,可用于血管生成方面的治疗(与HGF、VCAM-1这两个因子相关),而属于DP来源间充质干细胞则由于VEGF和Ang-1分泌表达水平高,可能用于严重下肢缺血性治疗比较好。我们相信,随着研究的不断深入,不同来源的间充质干细胞,有望更精准地在不同的治疗方向发挥作用。
推荐
